Leishmaniosi

Cos’è la Leishmaniosi?
La leishmaniosi canina è una malattia infettiva causata da protozoi del genere Leishmania a trasmissione indiretta (si può propagare tramite un insetto vettore, a carattere zoonosico (può essere trasmessa dal cane all’uomo e viceversa). La leishmaniosi umana è considerata in molti Paesi un grave problema di salute pubblica; del resto il parassita risulta largamente diffuso, minacciando persone i 4 diversi continenti. L’incidenza annuale della malattia è stimata intorno a 1,5-2 milioni di nuovi casi all’anno.
Nell’animale la malattia ha generalmente andamento cronico, per cui si ha una prolungata persistenza del microrganismo. In questo senso è interessante rilevare come Leishmania sia un “formidabile” parassita, in quanto permette una sopravvivenza protratta dell’ospite canino, e quindi anche di se stessa, almeno fino alla successiva stagione di trasmissione (disponibilità dell’insetto vettore
La Leishmania sarebbe niente senza il suo ospite invertebrato, il flebotomo vettore, l’insetto che il parassita sfrutta a proprio vantaggio per compiere parte del suo ciclo biologico, senza che lo stesso venga in qualche modo danneggiato, per lo meno in senso “vitale”, in realtà, come vedremo in seguito, l’insetto subisce alcune piccole alterazioni finalizzate alla sopravvivenza ed alla trasmissione del parassita.
Il protozoo viene definito dixeno, in quanto ha bisogno di due ospiti biologicamente diversi (il flebotomo ed il mammifero) per compiere il proprio ciclo vitale (ciclo biologico). È anche definito dimorfico, perché esiste in 2 forme differenti: promastigote ed amastigote.
La prima è quella che Leishmania assume nell’insetto (ed in laboratorio, nei mezzi di coltura), con una morfologia allungata e sottile, provvista di flagello (struttura adibita al movimento ed all’interazione con le strutture cellulari dell’ ospite), della lunghezza di 15-30 micron (1 micron = 0,001 millimetri) per 2-3 micron di larghezza. L’amastigote, forma parassitaria del cane, ha invece una struttura globosa od ovalare, di 2-6 per 2-3 micron, e si localizza prevalentemente all’interno delle cellule fagocitiche mononucleate.
I flebotomi o pappataci sono insetti ditteri (hanno 2 ali); nel bacino del Mediterraneo l’unico genere coinvolto nella trasmissione di Leishmania infantum (la sola specie del protozoo responsabile della malattia alle nostre latitudini) è il Phlebotomus, con alcune specie, tra cui P. perniciosus, P. perfiliewi e P. major. Il ciclo vitale dei flebotomi comprende due diversi stadi biologici: l’adulto volante e la fase di sviluppo (uovo, 4 stadi larvali e pupa), che si realizza in terreni umidi ricchi di materiale organico. Gli adulti hanno 2-4 mm di lunghezza ed il corpo giallastro e peloso. Durante il giorno restano in luoghi oscuri e riparati: abitazioni, cantine, stalle, grotte, crepe dei muri, delle rocce e del suolo, fitta vegetazione, buchi degli alberi, tane di roditori o di altri animali, nidi di uccelli e formicai.
L’attività dei flebotomi si realizza nelle ore crepuscolari(un picco appena dopo il tramonto) e notturne. Possono arrivare a coprire fino a 2,3 chilometri e la loro velocità è di circa 1 metro al secondo. Solo le femmine di pappatacio si nutrono di sangue, al fine di permettere la maturazione delle uova (il tempo che intercorre fra un pasto di sangue e la maturazione delle uova è di 4-8 giorni). Analogamente ad altri artropodi ematofagi, il pasto di sangue da parte del flebotomo è preceduto, a livello della superficie cutanea dell’ospite, dalla deposizione di saliva, che contiene sostanze farmacologicamente attive, come anticoagulanti e vasodilatatori (per agevolare la successiva suzione), le quali possono determinare reazioni “allergiche” più o meno gravi. Allorché un flebotomo di sesso femminile punge un mammifero infetto, può ingerire amastigoti intracellulari (probabilmente anche extracellulari) che passano direttamente nella parte addominale dell’intestino. All’interno del pasto di sangue gli amastigoti si trasformano in promastigoti mobili che si moltiplicano attivamente. Successivamente i parassiti migrano verso la parte anteriore dell’intestino, in cui divengono promastigoti metaciclici, le forme infettanti per l’ospite vertebrato (cane) e quindi si localizzano nelle strutture pungitrici. Il tempo minimo in cui si realizzano queste trasformazioni (pasto di sangue – promastigoti metaciclici) è di 5-6 giorni (fino a 19-20, in dipendenza soprattutto delle condizioni climatico-ambientali). La successiva puntura del flebotomo infetto deposita i promastigoti nella cute, e le cellule fagocitarie mononucleate del cane “inglobano” tali promastigoti che si trasformano quindi in amastigoti e si moltiplicano per semplice divisione binaria. I meccanismi che consentono il successo della trasmissione dei promastigoti, dall’apparato buccale del flebotomo alla cute dell’ospite mammifero, sono solo in parte chiariti, ma è evidente che il parassita riesce ad inibire, in qualche misura, la suzione dell’insetto che, almeno inizialmente, ostacolerebbe la “penetrazione” dei promastigoti nell’organismo. Essi infatti producono alcune sostanze che impediscono l’assunzione di sangue da parte del flebotomo, addirittura arrivando a determinare un certo grado di degenerazione dell’apparato pungitore, evento che favorisce il rigurgito dei parassiti stessi.
Le zone a rischio
Fino a pochi anni fa si affermava che la leishmaniosi canina fosse confinata in zone relativamente limitate del centro-sud Italia e delle isole (maggiori e minori).
Oggi questa affermazione risulta alquanto inesatta. Studi e ricerche condotte negli ultimi anni hanno stabilito che il Flebotomo ha mutato di parecchio il suo habitat riuscendo a sopravvivere e portare a termine un ciclo biologico anche in zone che fino a poco tempo fa erano considerate sicure.
Basti pensare che oggi la presenza del flebotomo e della malattia, è stata riscontrata anche in Valle d’Aosta, nelle zone dei grandi laghi del nord Italia, nel Pavese e Pianura Padana, in zone come Trentino e Friuli Venezia Giulia. In tutte queste aeree il concomitante cambio climatico e lo sviluppo urbano ha portato a ricreare condizioni favorevoli simili a quelle che si incontravano solo qualche anno fa lungo le coste centro-sud Italia.
Contagio
Per quanto riguarda il contagio, bisogna prendere in considerazione anche altre possibilità oltre al classico flebotomo. Esiste anche la possibilità di un contagio diretto, ovvero senza l’intervento del flebotomo vettore. Nell’uomo è dimostrata la possibilità della trasmissione di Leishmania da madre a figlio durante la gravidanza. Anche nel cane recenti studi hanno confermato questa possibilità.
Un’altra possibilità di trasmissione provata è quella attraverso lo scambio di sangue trasfusionale, da un soggetto infetto ad uno sano, sia nell’uomo che nel cane. Il parassita sopravvive nelle sacche di sangue refrigerato, mentre alle temperature di congelamento il comportamento può variare: se è vero che un congelamento rapido uccide la maggior parte dei parassiti eventualmente presenti nel sangue, è altresì vero che il congelamento controllato (ovvero con l’aggiunta di crioprotettivi e rispettando certi tempi di raffreddamento), è la tecnica generalmente utilizzata per conservare collezioni di protozoi, cellule, embrioni, ecc. Ciò premesso, non si può che promuovere un controllo anche del sangue canino prima di destinarlo alle trasfusioni.
Il ruolo dell’immunità
L’immunità è di fondamentale importanza in questa patologia, è lei che “decide” se l’infezione (penetrazione del parassita nell’organismo canino) progredisce verso la malattia infettiva (leishmaniosi canina) o resta un’infestazione “benigna” (autolimitante). L’immunità viene distinta in umorale (produzione di anticorpi) e cellulo-mediata (attivazione di cellule contro gli agenti estranei), ma questa è più che altro una suddivisione didattica in quanto, nella lotta ai microrganismi patogeni, sono strettamente connesse e dipendenti. La patologia si realizza in quei cani in cui prevale un certo tipo di risposta immune, detta Th2 (dalla tipologia di cellule linfocitarie coinvolte), che non è in grado di attivare efficacemente l’immunità cellulo-mediata. Nei soggetti in cui prevale la risposta Th1 la malattia non si realizza (anche questa distinzione è didattica ed ormai appartiene al passato della ricerca scientifica sulla leishmaniosi). Molto probabilmente la prevalenza dell’una o dell’altra risposta dipende da ragioni (anche) genetiche, ma le intime ragioni non sono completamente note.
Come abbiamo visto, gli amastigoti di Leishmania si insediano principalmente nei macrofagi che, in condizioni normali, sono le cellule più potenti nella difesa aspecifica contro gli agenti infettivi: li “inglobano” (fagocitosi), li uccidono e quindi, una volta esaurito il loro compito, degenerano (apoptosi). In questo caso, invece, i macrofagi non solo non funzionano (o funzionano poco e/o male) ma finiscono per comportarsi da veri e propri “cavalli di Troia”. Infatti le leishmanie, all’interno di queste cellule, producendo particolari sostanze e/o “in virtù” delle loro strutture di superficie, riescono a sopravvivere ai potenti meccanismi “killer” macrofagici e, addirittura, ne ritardano od impediscono la normale degenerazione (i Greci restano nel cavallo così i Troiani non li possono vedere). In questo modo vengono trasportate, così protette nei confronti degli anticorpi e delle altre cellule coinvolte nei processi immunitari, in diverse sedi dell’organismo (milza, fegato, midollo osseo, linfonodi, occhi, ecc.), in cui continuano a proliferare. Non è finita qui, purtroppo. Le leishmanie all’interno dei macrofagi inducono una complessa alterazione dell’immunità del soggetto, non solo di quella cellulo-mediata, ma anche di quella umorale. Infatti stimolano la produzione di enormi quantità di anticorpi (immunoglobuline) che però non sono protettivi (come sarebbero se avessero potuto “vedere” i parassiti) e finiscono per arrecare i danni più gravi che si possono osservare in questa malattia (come quelli a livello renale ed oculare). Alcuni di tali anticorpi “difettosi”, addirittura, reagiscono contro strutture proprie dell’organismo canino (fenomeni immuno-patologici autoimmunitari), come quelle delle articolazioni (artrite/artrosi, dolori), dei muscoli (atrofia muscolare) e dei globuli rossi (anemia).
Sintomi
I possibili sintomi della malattia sono numerosissimi, ma spesso ne sono presenti solamente alcuni o uno o addirittura nessuno (infezione asintomatica, più frequente della sintomatica). Per questo scordiamoci subito di ottenere una diagnosi esclusivamente clinica: al massimo è ipotizzabile una diagnosi di sospetto.
Dopo un periodo d’incubazione piuttosto lungo (da un mese a 4 anni: dati sperimentali, in condizioni naturali il momento dell’infezione resta sconosciuto), la malattia si presenta solitamente in forma cronica e generalizzata, anche se ci possono essere manifestazioni prevalenti o quasi esclusive in singoli apparati (a differenza che nell’uomo in cui si distinguono le forme viscerale, cutanea, muco-cutanea e dermica-post-viscerale), con manifestazioni a carico della cute, delle mucose e di carattere generale.
Vediamo quali sono queste manifestazioni, in ordine di frequenza:
- · Ingrossamento dei linfonodi;
- · Lesioni cutanee (dermatite furfuracea, ulcere, alopecia perioculare e diffusa, unghie abnormemente lunghe, pustole, depigmentazione nasale, noduli non ulcerati);
- · Mucose pallide;
- · Dimagrimento;
- · Febbre;
- · Abbattimento;
- · Anoressia (perdita/assenza d’appetito);
- · Ingrossamento della milza e del fegato;
- · Insufficienza renale;
- · Lesioni oculari (non solo congiuntivite);
- · Fuoriuscita di sangue dalle narici;
- ·
La perdita di pelo, benché possa essere diffusa a tutto il corpo, si presenta di preferenza su alcune aree, non solo, come abbiamo visto, nel contorno degli occhi: padiglioni auricolari, dorso del naso, collo, prominenze ossee (gomiti, garretti, anche), regione lombare e coda. Le zone inizialmente alopeciche vanno incontro ad infiammazione e/o eczema furfuraceo ed eventualmente ad ulcerazione, anche se a volte, queste ultime lesioni, sono l’espressione di una sovrainfezione batterica (piodermite). Comunque sia le alterazioni cutanee puramente leishmaniotiche non sono pruriginose. L’aspetto generale del cane, in certi casi cutanei particolarmente avanzati, è quello di un soggetto anziano (“cane vecchio”). A volte si possono sovrapporre lesioni da rogna demodettica (rogna rossa), anche in animali adulti. Possono essere presenti zoppie più o meno evidenti, probabili espressioni di danni a livello muscolare, osseo ed articolare. Nei pazienti renali si evidenzia anche l’aumento dell’urinazione (poliuria) e della sete (polidipsia). Meno frequentemente si possono osservare diarrea, lesioni genitali, aborto nella fase avanzata della gravidanza ed alterazioni nervose come paresi e paralisi degli arti posteriori (soprattutto nelle rare forme acute).
Sono sempre presenti almeno alcune alterazioni degli esami di laboratorio, tra le quali, in ordine di frequenza, si annoverano: iperglobulinemia, basso rapporto albumina/globuline, ipoalbuminemia, iperproteinemia, anemia (diminuzione dei globuli rossi, dell’ematocrito, dell’emoglobina), diminuzione o aumento dei globuli bianchi, diminuzione delle piastrine, iperazotemia (aumento di creatininemia e BUN, indici [tardivi] più evidenti di danno renale), aumento di alcuni enzimi epatici nel sangue (transaminasi: ALT [ex GPT], AST [ex GOT]), presenza di proteine nelle urine (proteinuria: lesioni renali).
Per quanto riguarda la diagnosi, c’è da dire che la leishmaniosi non va confusa con alcune patologie (diagnosi differenziale), pure presenti nelle aree endemiche, che comunque possono anche manifestarsi concomitantemente alla leishmaniosi stessa: malattie trasmesse da zecche (ehrlichiosi, epatozoonosi, babesiosi), linfoma, dermatite allergica alimentare, da morso di pulci ed atopica, la già citata rogna demodettica e la sarcoptica (scabbia). Ai fini della diagnosi certa risultano fondamentali gli esami di laboratorio.
Si distinguono esami specifici (quelli che ricercano, direttamente o indirettamente, la presenza del parassita) ed aspecifici (quelli che indagano le alterazioni laboratoristiche di cui abbiamo parlato). Tra i primi ci sono i test rapidi ambulatoriali, gli esami citologici o bioptici (linfonodi, midollo osseo, milza) seguiti dall’osservazione microscopia, gli esami sierologici (immunofluorescenza indiretta, ELISA, ecc.) e le tecniche molecolari (PCR). Tra gli esami aspecifici merita menzione l’elettroforesi delle proteine sieriche: si tratta di un esame quali-quantitativo che svela l’eventuale alterazione delle sieroproteine (albumina, globuline alfa, beta e gamma) e dei loro rapporti; quadri di ipoalbuminemia ed aumento delle frazioni globuliniche beta e gamma, con proteine totali aumentate, sono decisamente sospetti di leishmaniosi. Questo saggio può essere utilizzato anche per il monitoraggio della bontà della terapia, anche se spesso i suoi risultati restano alterati piuttosto a lungo, pur in presenza – eventualmente – di uno stato clinico generale tutto sommato soddisfacente, se non perfetto.
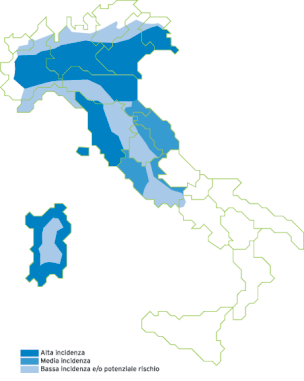
Aree di incidenza della filariosi cardiopolmonare
Alta incidenza si ha nella Pianura Padana, golfo di Venezia, costa tirrenica e coste della Sardegna.
Media incidenza costa Adriatica centrale, costa laziale nord.
Bassa incidenza nelle aree pedemontane delle Alpi, costa ligure, bassa costa laziale, entroterra tosco emiliano e entroterra sardo.

Terapie
La leishmaniosi canina è curabile dal punto di vista sintomatologico, ma praticamente inguaribile dal punto di vista parassitologico. Alcuni affermano che, in seguito ad opportuna terapia, è possibile la guarigione completa, ma la tendenza più diffusa del mondo scientifico è quella di considerare la Leishmania sempre presente, in qualche modo ed in qualche sede, nell’organismo. Frequentemente invece, quando le condizioni iniziali del cane non sono disperate (soprattutto la funzionalità renale), si ottiene la scomparsa dei sintomi (soprattutto quelli cutanei) e l’animale può condurre, anche per lungo tempo, un’esistenza soddisfacente (un animale asintomatico o con pochi sintomi è anche molto meno fonte d’infezione rispetto ad uno sintomatico).
Ad oggi ci sono solo tre farmaci capaci di controllare egregiamente i sintomi, abbassare la carica parassitaria e prevenire le recidive e sono:
L’Antimoniato di N-Metilglucamina (Glucantime iniettabile)
La Miltefosina (Milteforan compresse)
L’Allopurinolo (zyrolic compresse).

Prevenzione
Gli unici interventi praticamente realizzabili, che forniscono risultati variamente incoraggianti, sono quelli di prevenzione delle punture dei flebotomi.
I possibili metodi d’intervento sono diversi e possono/debbono essere adottati anche in associazione tra loro. Si deve evitare, per quanto possibile, di far dormire il cane all’aperto durante la notte, durante il periodo primaverile-estivo: la maggior parte degli animali infetti vive costantemente in box a cielo aperto; il fatto che i cani esclusivamente adibiti alla compagnia – segnatamente quelli di piccola taglia – siano colpiti dalla malattia in bassa percentuale, riflette proprio il loro stile di vita prevalentemente domestico. Analogamente anche le passeggiate serali rappresentano un rischio potenziale anche se, durante il movimento, le punture dei flebotomi risultano difficoltose. I box e le finestre delle abitazioni dovrebbero essere dotati di zanzariere a maglia fitta (lato non superiore a 2 mm), eventualmente impregnate con qualche buon prodotto insetticida-insettorepellente. Possono essere utili anche i dispositivi elettrici “friggi-zanzare” o le “trappole appiccicose”, da porre nelle immediate vicinanze dei luoghi di riposo notturni dei cani.
Un discorso a parte deve essere dedicato ai prodotti repellenti da applicare direttamente sulla cute e sul pelo degli animali: le sostanze dotate di migliore attività contro i pappataci sono risultati i piretroidi sintetici. In commercio sono presenti diverse formulazioni spray a base di permetrina (Duowin®, Defendog®), o sostanze naturali (Olio di Neem). A prescindere dalle quantità in cui sono presenti i componenti attivi, questi prodotti soffrono di limiti insiti nella loro modalità di applicazione, che risulta discontinua e poco controllabile. Exspot® ed Advantix® sono formulazioni spot-on (pipette da spremere sulla cute) a base di permetrina (+ imidacloprid, un antipulci, nel secondo), che studi scientifici dimostrano essere efficaci nella prevenzione delle punture dei flebotomi. Dal 1997 ad oggi sono comparse numerose pubblicazioni su ricerche effettuate per valutare l’effetto “anti-feeding” (contro il pasto di sangue) nei confronti dei pappataci, da parte del collare Scalibor Protector Band® (principio attivo: deltametrina). Questi studi dimostrano come l’applicazione di detto collare ai cani che vivono in aree fortemente endemiche per leishmaniosi, risulti in una protezione statisticamente significativa, in comparazione ai cani di controllo (senza collare). Valutando il tasso di sieroconversione (comparsa degli anticorpi anti-Leishmania) sono state ottenute percentuali di protezione fino al 75-86%, in dipendenza della diversa pressione di diffusione stagionale dei flebotomi. Pur trattandosi di dati estremamente positivi, non si deve dimenticare che il collare e/o le gocce non possono rappresentare una protezione “assoluta” (come qualsiasi dispositivo “anti-pappatacio”). Si può però supporre, come lasciano intuire alcuni studi, che l’utilizzo massivo di questi mezzi preventivi possa portare ad una riduzione dei casi di leishmaniosi canina ed umana, al di là del valore profilattico per i singoli animali.
Oggi è disponibile finalmente il Vaccino: ricercatori di alto livello Mondiale hanno creato il primo vaccino in Europa contro la Leishmaniosi canina.
Lo scopo è quello di coadiuvare la difesa “esterna” operata dagli antiparassitari con una “interna” che sviluppa le difese naturali nei confronti del parassita potenziando il suo sistema immunitario.
Ad oggi il vaccino è stato sviluppato dalla ditta farmaceutica(che opera solo per la salute animale) Virbac la quale consiglia come strategia vincente, la combinazione della vaccinazione e della profilassi insetticida.
Per ottenere maggiori informazioni circa il test, la profilassi e la nuova vaccinazione
contatta la Clinica al numero
0363 19 000 53
Ricorda che per avere una copertura efficace nei mesi estivi, il programma vaccinale dovrebbe essere iniziato entro la fine di marzo
Questo sito è stato realizzato con Jimdo! Registra il tuo sito gratis su https://it.jimdo.com
